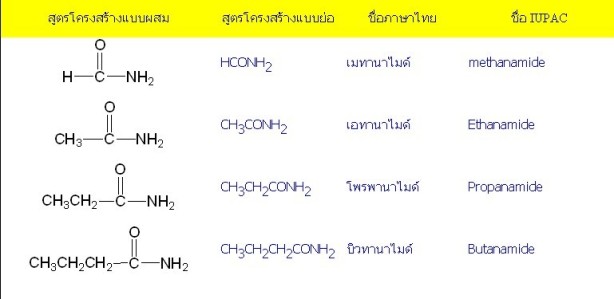
เอไมด์
การเรียกชื่อเอไมด์ ให้เรียกตามจำนวนอะตอมของคาร์บอน แล้วเปลี่ยนเสียงลงท้ายเป็น –อานาไมด์ (–anamide) เช่น
สมบัติของเอไมด์
1. เอไมด์เป็นโมเลกุลมีขั้ว มีแรงยึดเหนี่ยวระหว่างโมเลกุลเป็นพันธะไฮโดรเจน
2. จุดเดือดของเอไมด์ มีแนวโน้มเพิ่มขึ้นตามจำนวนอะตอมของคาร์บอน เอไมด์ส่วนใหญ่มีสถานะเป็นของแข็งที่อุณหภูมิห้อง และจุดเดือดสูงกว่าเอมีนที่มีมวลโมเลกุลใกล้เคียงกัน เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลของเอไมด์สูงกว่าเอมีน พันธะไฮโดรเจนที่เกิดระหว่างหมู่ กับ มีความแข็งแรงมากกว่าพันธะไฮโดรเจนในโมเลกุลของเอมีน
พันธะไฮโดรเจนระหว่างโมเลกุลของเอไมด์
3. เอไมด์ที่มีโมเลกุลขนาดเล็กละลายน้ำได้ แต่สภาพละลายได้จะลดลงมื่อจำนวนอะตอมคาร์บอนเพิ่มขึ้น จนถึงไม่ละลายน้ำ สารละลายของเอไมด์มีสมบัติเป็นกลาง เนื่องจากอะตอมของออกซิเจนในหมู่คาร์บอนิลดึงดูดอิเล็กตรอนจากอะตอมของไนโตรเจนในหมู่อะมิโน เป็นผลทำให้ไนโตรเจนมีสภาพขั้วไฟฟ้าค่อนข้างบวก จึงไม่สามารถรับโปรตอนจากน้ำได้
4. เอไมด์สามารถเกิดปฏิกิริยาไฮโดรลิซิส ในสารละลายกรด หรือสารละลายเบส ได้ผลิตภัณฑ์เป็นกรดคาร์บอกซิลิก และเอมีน ดังสมการ
ประโยชน์ของเอไมด์
เอไมด์ที่ใช้มาก ได้แก่ อะเซตามิโนเฟน หรืออีกชื่อหนึ่งคือพาราเซตามอล หรือไทลินอล ใช้ผสมในยาบรรเทาปวดและลดไข้
Paracetamol
ชื่อในระบบ IUPAC : N-(4-hydroxyphenyl)acetamide
อะเซตามิโนเฟน หรือพาราเซตามอล
ยูเรีย เป็นเอไมด์ที่พบในปัสสาวะของสัตว์เลี้ยงลูกด้วยนม เป็นผลิตภัณฑ์ที่ได้จากการสลายโปรตีน ซึ่งปกติคนจะขับถ่านยูเรียวันละประมาณ 20–30 กรัมต่อวัน
Urea

โครงสร้างสามมิติของยูเรีย (Urea)
วัฏจักรของยูเรีย
ยูเรียเป็นสารประกอบอินทรีย์ชนิดแรกที่สังเคราะห์ขึ้นจากแอมโมเนียมไซยาเนต ซึ่งเป็นสารอนินทรีย์ ยูเรียใช้เป็นปุ๋ย และวัตถุดิบในการผลิตพลาสติกประเภทพอลิยูเรียฟอร์มาลดีไฮด์ ในทางอุตสาหกรรมเตรียมยูเรียได้จากปฏิกิริยาระหว่าง CO2 กับ NH3 ดังสมการ
|
CO2 + NH3 |
H2NCONH2 + H2O |
|

วัฏจักรของยูเรีย

ยูเรีย (Urea)